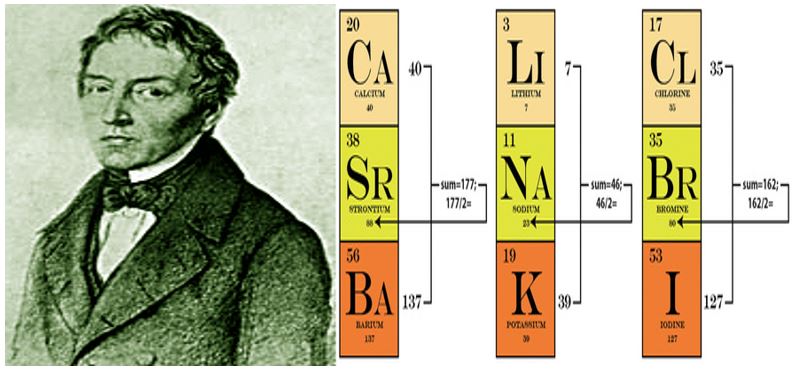Periyodik sistem
Element atomuyla ilgili bilinmesi gerekenler:
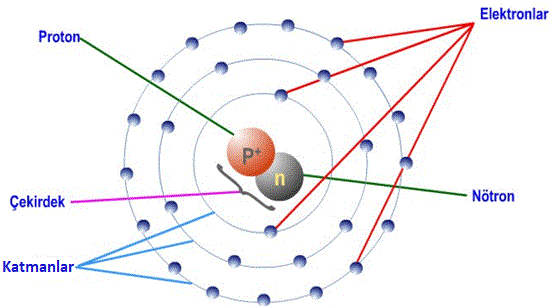
Proton:
- Atom numarası olarak da bilinir.
- Atomun çekirdeğinde bulunur.
- + yüklü hareketsiz taneciklerdir.
- Maddenin kimliğini belirleyen taneciktir.
- Elementin proton sayısı kesinlikle değişmez.
- Proton sayısı= elektron sayısı +iyon yükü
Nötron:
- Atomun çekirdeğinde bulunur.
- Yüksüz ve hareketsiz taneciklerdir.
Elektron:
- Çekirdeğin etrafında sürekli olarak 3 boyutlu hareket halindedir.
- – yüklü taneciklerdir.
Kütle numarası:
- Atom kütlesi olarak da ifade edilir.
- Proton ve nötron sayıları toplanarak bulunur.
- Elektronların sahip oldukları ağırlıkları yok denecek kadar az olduğu için hesaplamaya katılmaz.
- Kütle numarası= proton sayısı + nötron sayısı
İyon yükü:
- Elektron alışverişi yapan atomlara iyon denir.
- Atom elektron vermiş ise + yüklü iyon şeklini alır.
- Atom elektron almış ise – yüklü iyon şeklini alır.
Geçmişten günümüze periyodik sistem:
- Bilinen Tüm elementleri belirli bir düzene göre sıralayan sisteme periyodik sistem denir.
- Elementlerin incelenmesini kolaylaştırır.
- Periyodik tablo, periyodik cetvel, periyodik çizelge, periyodik sistem gibi isimlerle de anılabilir.
Wolfgang Döbereiner:
- Periyodik tablo ile ilgili ilk çalışmayı yapmıştır.
- Periyodik tabloyu benzer özellikler gösteren üçerli gruplar oluşturarak yapmıştır. (Triadler kuralı)
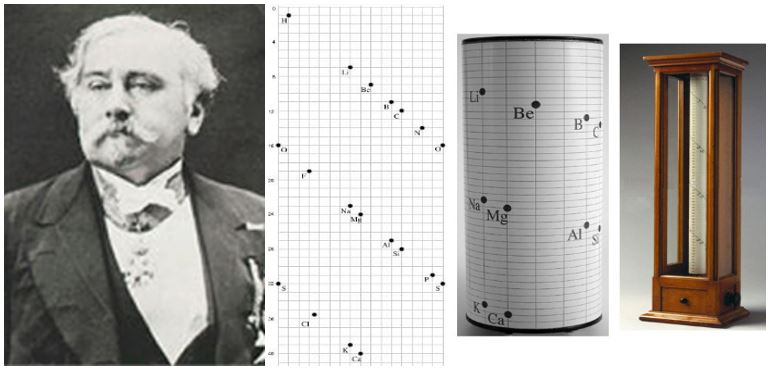
Alexandre Beguyer de Chancourtois:
- Benzer fiziksel özellik gösteren elementleri dikey sıralarda olacak şekilde sarmal olarak sıralayarak oluşturmuştur.
- Oluşturduğu periyodik tabloda elementler dışında bazı iyonlar ve bileşiklere de yer vermiştir.
John Newlands:
- O günlerde bilinen 62 elementi atom ağırlıklarına göre sıraladı ve benzer özellik gösterenleri gruplara ayırarak tabloyu oluşturdu.
- Oluşturduğu tabloyu müzik notalarına benzetmiştir.
- Newlands’a göre atom ağırlıkları 8’in katı olan elementler benzerdir ve bir numaralı elementten sonra gelen sekizinci element ilk elementin bir çeşit tekrarıdır. (Oktav kanunu)
Dimitri Ivanovic Mendeleyev – Lothar Meyer:
- Birbirinden habersiz aynı çalışmaları yapmışlardır. Ancak Mendeleyev elementleri artan atom ağırlıklarına göre sıralarken, Meyer benzer fiziksel özelliklerine göre sınıflandırmıştır.
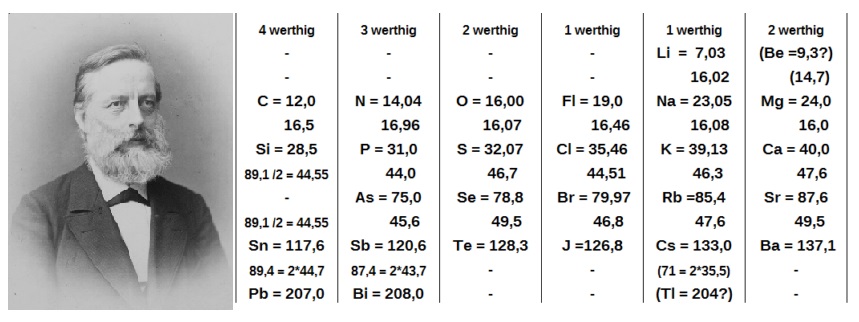
- Mendeleyev 12 satır ve 8 sütundan oluşan tabloyu hazırladı ve bazı yerleri henüz keşfedilmedi diye boş bıraktı.
- Mendeleyev’in oluşturduğu tablo günümüzdeki tabloya en yakındır. Bu yüzden periyodik tablonun “babası” olarak bilinir.
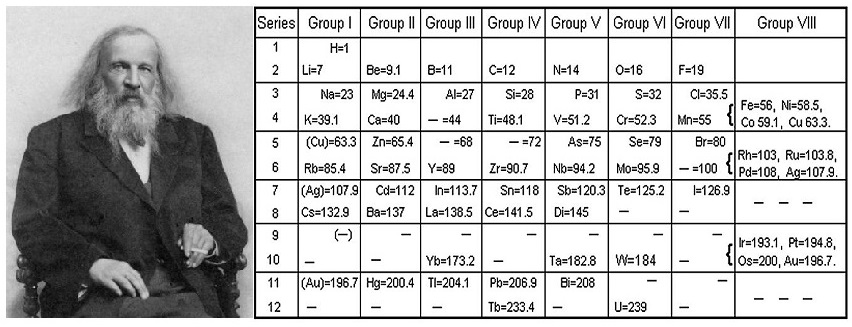
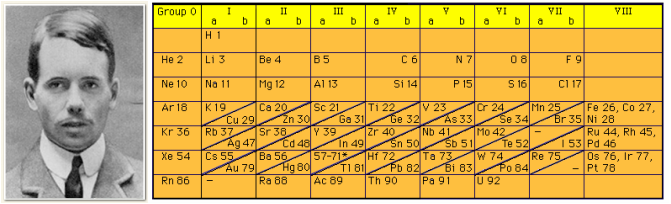
Henry Moseley:
- Elementleri atom numaralarına(proton sayısı) göre sınıflandırarak periyodik sistemi düzenledi.
Glenn Seaborg:
- En alttaki iki sırayı ekleyerek (lantanit-aktinit) periyodik cetvele son halini vermiştir.
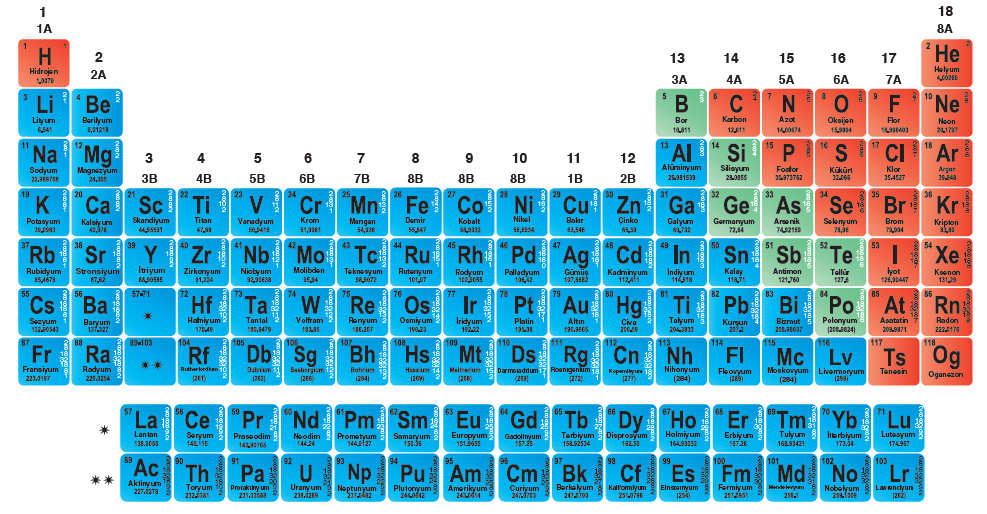
Periyodik sistem:
Elementlerin belirli bir düzene göre sıralanıp sınıflandırıldığı, element atomları ile ilgili bilgiler içeren çizelgeye periyodik sistem denir.
Periyodik cetvelin özellikleri:
- Periyodik tabloda 7 tane periyot, 18 tane grup vardır.
- Periyodik tabloda yatay sıralara periyot, dikey sıralara grup
- Gruplardan 8 tanesi A grubu, 10 tanesi B grubudur.
- Aynı grupta bulunan elementler birçok yönden benzer özelikler gösterir.
- 1. Periyotta Hidrojen ve Helyum olmak üzere iki element vardır. 2. ve 3. Periyotta 8’er tane element vardır.
- B grubu elementleri 4. Periyottan itibaren başlar.
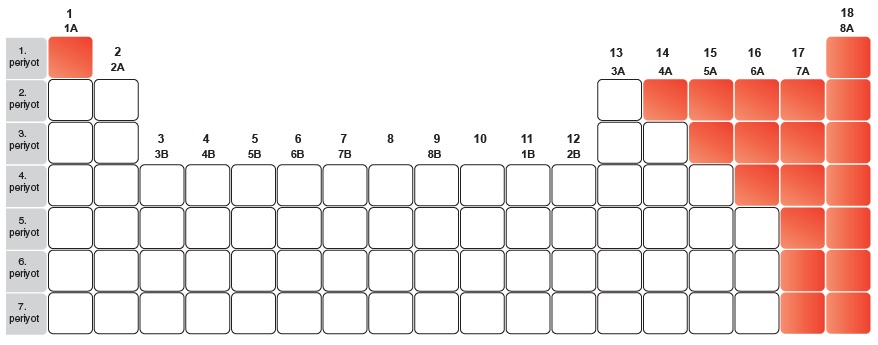
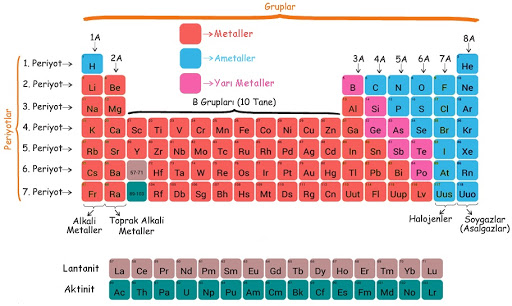
- Tablonun sol tarafında metaller, sağ tarafında ise ametaller vardır.
- Elementin son yörüngesindeki elektron sayısına değerlik elektron sayısı Değerlik elektron sayısı bize grup numarasını verir.
- Periyot sayısı, enerji seviyesi, katman sayısı, yörünge sayısı aynı anlama gelmektedir.
- Periyodik cetvel; metal, ametal ve yarı metal olmak üzere üç sınıfa ayrılır.
- Periyodik cetvelde bazı grupların özel isimleri vardır.
- 1A Grubu – Alkali metaller
- 2A Grubu – Toprak alkali metaller
- 3A Grubu – Toprak metaller
- 7A Grubu – Halojenler
- 8A Grubu – Soygazlar(Asal gazlar)
Metaller:
- Periyodik tablonun sol tarafında bulunurlar. (Hidrojen hariç)
- Parlak renge sahiptirler.
- Isı ve elektriği iyi iletirler.
- Civa hariç hepsi oda sıcaklığında katı halde bulunurlar.
- Elektron vermeye yatkındırlar.
- Bileşik oluştururken (+) yüklü katyon oluştururlar.
- Atomik yapıdadırlar.
- Tel ve levha haline gelebilirler, işlenebilirler.
- Metallerle karışım oluştururlar. (alaşım)
- Ametallerle elektron alış-verişi yaparak iyonik bağlı bileşik oluştururlar.
- Erime ve kaynama noktaları yüksektir.
- Sulu çözeltileri bazik özellik gösterir.
- Canlıların yapısında çok az bulunur.
Ametaller:
- Periyodik tablonun sağ tarafında bulunurlar.
- Mat renge sahiptirler.
- Isı ve elektriği iyi iletmezler.
- Oda sıcaklığında katı, sıvı ve gaz halde bulunabilirler.
- Elektron almaya yatkındırlar.
- Bileşik oluştururken (–) yüklü anyon oluştururlar.
- Moleküler yapıdadır.
- Kırılgandırlar. Tel ve levha haline gelemezler.
- Metallerle elektron alış-verişi yaparak iyonik bağlı bileşik oluştururlar.
- Ametallerle elektron ortaklaşa kullanımı ile kovalent bağlı bileşik oluştururlar.
- Erime ve kaynama noktaları metallere göre düşüktür.
- Sulu çözeltileri asidik özellik gösterir.
- Canlıların yapısında bol miktarda bulunur.
Soygazlar:
- Periyodik tablonun en sağında bulunur.
- Oda sıcaklığında gaz haldedirler.
- Kararlı bir yapıda oldukları için elektron alıp vermezler. Diğer elementler ile bileşik oluşturmazlar.
- 8A gurubunda yer alırlar.
- Tek atomlu, atomik yapıdadırlar.
- Son katmanlarında maksimum sayıda elektron vardır.
Yarı metaller:
- Görünüşleri parlak veya mat olabilir.
- Tel ve levha haline getirilebilirler.
- Elektriği ve ısıyı metallere göre daha az iletirler.
- Elektronik devrelerde ve optik malzemelerin yapımında kullanılır.
- Oda sıcaklığında katı halde bulunurlar.
- Bor, silisyum, germanyum, arsenik, tellür ve polonyum yarı metallere örnektir.
- Fiziksel özellikleri metallere benzerler.
- Kimyasal özellikler ametallere benzerler.
Periyodik cetvelde yukarıdan aşağı doğru inildikçe:
- Atom numarası artar.
- Kütle numarası artar.
- Elektron sayısı artar.
- Metalik özellik artar.
- Ametalik özellik azalır.
- Elektron verme isteği artar, elektron alma isteği azalır.
- Atom çapı büyür.
- Değerlik elektron sayısı, grup numarası değişmez.
- Periyot sayısı artar.
Periyodik cetvelde soldan sağa doğru gidildikçe:
- Atom numarası artar.
- Kütle numarası artar.
- Elektron sayısı artar.
- Metalik özellik azalır.
- Ametalik özellik artar.
- Elektron verme isteği azalır, elektron almaz isteği artar.
- Atom çapı küçülür.
- Değerlik elektron sayısı, grup numarası artar.
- Periyot sayısı değişmez.
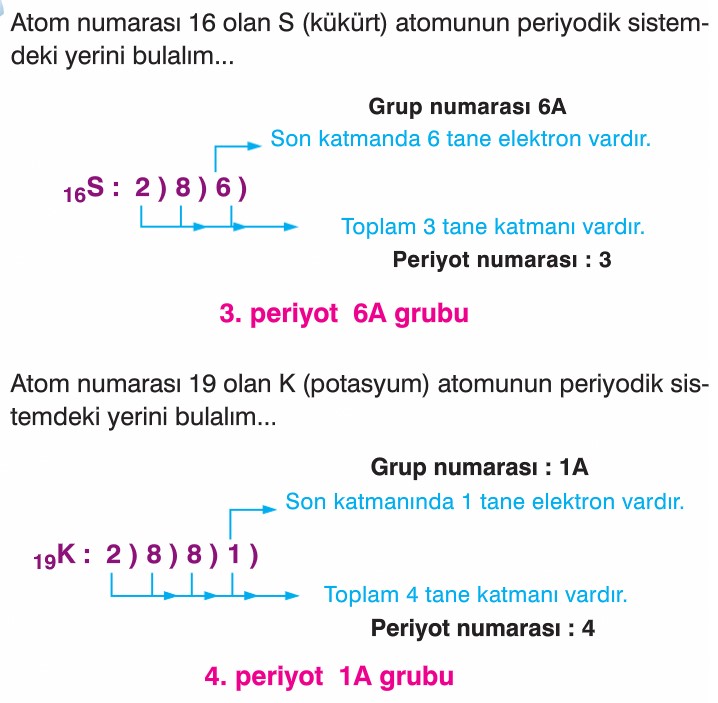
Elementin periyodik tabloda yerini bulma:
- Periyodik tabloda bir elementin yeri bulunurken, o elementin nötr haldeki elektron dizilimine bakılır.
Unutma: Proton sayısı elektron sayısına eşit ise nötr atom denir.
- Periyot maksimum 2 elektron alır, 2. Periyot maksimum 8 elektron alır, 3. Periyot maksimum 8 elektron alır.
- Elektron dağılımı yapılırken; 1. Periyot dolmadan 2. Periyoda geçilmez, 2. Periyot dolmadan 3. Periyoda geçilmez, 3. Periyot dolmadan 4. Periyoda geçilmez.
- Elektron dizilimi yapıldıktan sonra oluşan dağılımda kaç periyot varsa bize periyot numarasını verir ve son periyotta bulunan elektron sayısı (değerlik elektron sayısı) bize grup numarasını verir.
Unutma: Helyumun son periyodunda elektron sayısı 2 olmasına rağmen 8A grubunda yer alır. Çünkü kararlı yapıdadır.
“PERİYODİK SİSTEM” KONU ANLATIMINI PDF OLARAK İNDİR.
İlgili İçerikler
-
 DNA ve Genetik Kod
Yorum yapılmamış | Eki 1, 2022
DNA ve Genetik Kod
Yorum yapılmamış | Eki 1, 2022 -
 Kimyasal Tepkimeler
Yorum yapılmamış | Oca 1, 2023
Kimyasal Tepkimeler
Yorum yapılmamış | Oca 1, 2023 -
 Biyoteknoloji
Yorum yapılmamış | Kas 14, 2021
Biyoteknoloji
Yorum yapılmamış | Kas 14, 2021 -
 Sunu: İklim ve Hava Hareketleri
Yorum yapılmamış | Eyl 14, 2020
Sunu: İklim ve Hava Hareketleri
Yorum yapılmamış | Eyl 14, 2020