Maddenin Tanecikli Yapısı
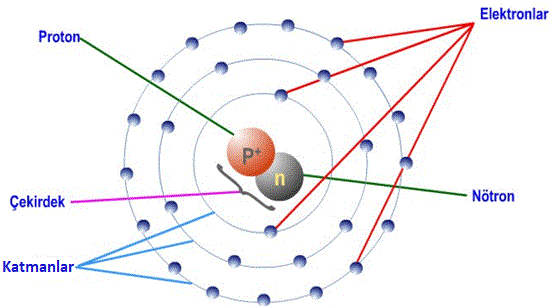
Atomun yapısı:
- Bir maddeyi oluşturan ve bu maddenin bütün kimyasal özelliklerine sahip olan en küçük parçacığına atom denir.
- Atomun temel parçacıkları vardır. Bunlar: Proton, nötron ve elektronlardır.
Proton:
- Atom numarası olarak da bilinir.
- Atomun çekirdeğinde bulunur.
- “p” harfi ile gösterilir.
- (+) yüklü hareketsiz taneciklerdir.
- Maddenin kimliğini belirleyen taneciktir.
Nötron:
- Atomun çekirdeğinde bulunur.
- Yüksüz ve hareketsiz taneciklerdir.
- “n” harfi ile gösterilir.
Elektron:
- Çekirdeğin etrafında katmanlarda sürekli olarak 3 boyutlu hareket halindedir.
- (–) yüklü taneciklerdir.
- “e” harfi ile gösterilir.
 Unutma! Bir atomun sahip olduğu kütleyi hesaplarken proton ve nötronun atom kütlelerine göre hesap yapılır. Proton ve nötronun sahip olduğu kütleler birbirine yakın değerdedir ve ikisi de bu hesaplamaya katılır. Elektronların sahip olduğu kütle yok denecek kadar az olduğu için bu hesaplamaya dahil edilmez.
Unutma! Bir atomun sahip olduğu kütleyi hesaplarken proton ve nötronun atom kütlelerine göre hesap yapılır. Proton ve nötronun sahip olduğu kütleler birbirine yakın değerdedir ve ikisi de bu hesaplamaya katılır. Elektronların sahip olduğu kütle yok denecek kadar az olduğu için bu hesaplamaya dahil edilmez.
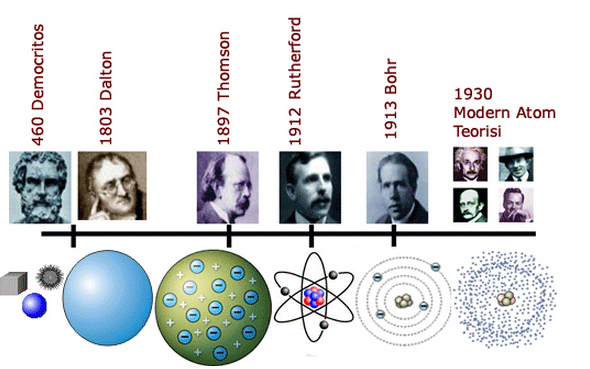
Atom ile ilgili tarihsel süreç:
Democritus: Maddenin taneciklerden oluştuğu fikrini ortaya attı. Bu taneciklere atomos adını verdi. Bu görüşü bilimsel olarak değil varsayım olarak söylemiştir. Democritus’a göre bütün maddelerin atomları aynıdır, atom görülemez ve bölünemez demiştir.
John Dalton: Atom hakkında ilk bilimsel açıklamayı yaptı. Dalton’a göre maddenin en küçük yapı birimi atomdur. Atomların içleri dolu berk kürelerden oluşmaktadırlar. Bütün maddelerin farklı cins atomlardan oluştuğunu da söylemiştir.
John Joseph Thomson: Atomu üzümlü keke benzettiği modelle açıkladı. Atomun dış katmanı pozitif (+) içinde ise negatif (-) yükler bulunmaktadır. Negatif yüklerin hareket etmediğini söylemiştir. Atomun parçalanabileceğini belirtmiştir.
Ernest Rutherford: Pozitif yüklere proton adını vermiştir. Protonun bulunduğu yere çekirdek demiştir. Çekirdek etrafında elektronların hareket halinde olduğunu keşfetti. Yaptığı model güneş sistemine benzetmiştir.
Niels Bohr: Elektronların çekirdeğin çevresinde istedikleri gibi dolaşamadığını, çekirdeğe belirli uzaklıklardaki katmanlarda dönebileceğini söylemiştir.
James Chadwick: Chadwick, çekirdekte nötron adı verilen taneciklerin bulunduğunu keşfetti. Chadwick, Bohr’un atom modelinin doğru olduğunu söylemekle birlikte elektronların çekirdeğin çevresindeki yerlerinin kesin olarak bilinemeyeceğini ortaya koydu.
Modern Atom Teorisi: Günümüzde geçerliliğini koruyan atom görüşüdür. Bu Teori’ye göre, elektronlar çok hızlı hareket ettikleri için katmanların yerine, elektronların bulunma ihtimalinin yüksek olduğu elektron bulutlarında yer aldığı savunulmuştur.
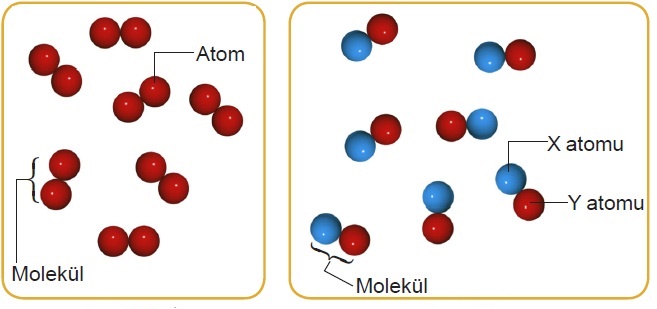
Molekül:
Aynı ya da farklı atomlar bir araya gelerek oluşturduğu yapıya molekül adı verilir. Aşağıda verilen şekilde aynı atomların bir araya gelerek oluşturduğu moleküller ile farklı atomların bir araya gelerek oluşturduğu moleküller gösterilmiştir. Aynı element atomlarının bir araya gelerek oluşturduğu moleküllere element molekülü, farklı elementlerin atomlarının bir araya gelerek oluşturduğu moleküllere bileşik molekülü denir.