Asitler ve Bazlar
Asitler:
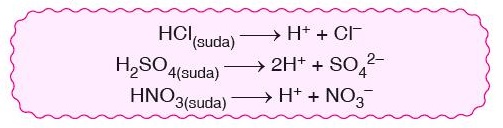
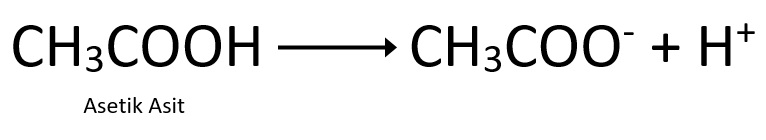
- Suda çözündükleri zaman ortama H+ iyonu veren maddelere asit denir.
- Tatları ekşidir.
- Mavi turnusol kağıdının rengini kırmızıya çevirir.
- Mikrop öldürücü etkisi vardır. (antiseptik)
- Yakıcı, tahriş edici, patlayıcı özellikleri vardır.
- Sulu çözeltileri elektrik akımını iletir.
- PH ölçeğinde 0-7 arasında yer alır.
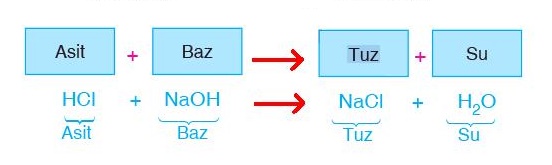
- Bazlarla birleşerek tuz ve su oluştururlar.
- Asitler, plastik ve camlara etki edemezler. Bu yüzden asitler plastik veya cam kaplarda saklanmalıdır.
- Asitler mermer ve metal yüzeyleri aşındırır. Bu yüzden metal kaplarda saklanamazlar.
- Asitler, metaller ile tepkimeye girerek tuz ve hidrojen gazı açığa çıkarır.
- Sulu çözeltilerinde büyük oranda iyonlarına ayrışabilen asitlere kuvvetli asit denir. Zayıf asitlerin sadece bir kısmı suda iyonlarına ayrışır. Kuvvetli asitler çok tahriş edici ve yakıcıdır. Kağıt, kumaş, et gibi birçok maddeyi kısa sürede parçalayabilir.
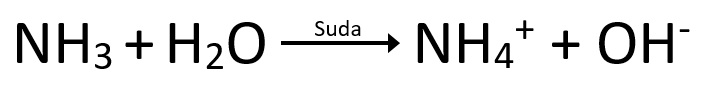
- Bir bileşiğin içinde H+ olması onun asit olacağını kanıtlamaz. Amonyak (NH3) bir bazdır.
- Tüm asitlerin yapısında hidrojen bulunmaz ancak suda çözündükleri zaman ortama H+ verirler.
- Asitlerin suda çözündükleri zaman ortama verdiği H+ iyon sayısı OH– iyon sayısından daha fazladır.
Bazlar:
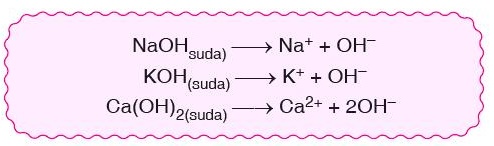
- Suda çözündükleri zaman ortama OH– (Hidroksit) iyonu veren maddelere baz denir.
- Tatları acıdır.
- Kırmızı turnusol kağıdının rengini maviye çevirir.
- Ele kayganlık hissi verir.
- Kuvvetli bazların tahriş edici özelliği vardır.
- Sulu çözeltileri elektrik akımını iletir.
- PH ölçeğinde 7-14 arasında yer alır.
- Asitler birleşerek tuz ve su oluştururlar.
- Bazlar cam, kristal ve porselenleri matlaştırır.
- Metaller bazlarla reaksiyon vermezler.
- Sulu çözeltilerinde büyük oranda iyonlarına ayrışabilen bazlara kuvvetli baz denir. Zayıf bazların sadece bir kısmı suda iyonlarına ayrışır.
- Bir bileşiğin içinde OH– olması onun baz olacağını kanıtlamaz.
- Tüm bazların yapısında OH– bulunmaz ama suda çözündükleri zaman ortama OH– iyonu verirler.
- Bazlar suda çözündükleri zaman ortama verdiği OH– iyon sayısı H+ iyon sayısından daha fazladır.
- Genelde temizlik malzemesi yapımında kullanılır.
Asit-Baz belirteçleri:
Maddelerin asit veya baz olduğunu anlamak için kullanılan maddelere belirteç denir.
|
|
ASİT |
BAZ |
|
Turnusol Kağıdı |
Maviden kırmızıya | Kırmızıdan maviye |
|
Metil Oranj |
Kırmızı | Sarı |
| Fenolftalein | Renksiz |
Pembe |
| Kırmızı Lahana | Kırmızı-Pembe |
Mavi-Yeşil |
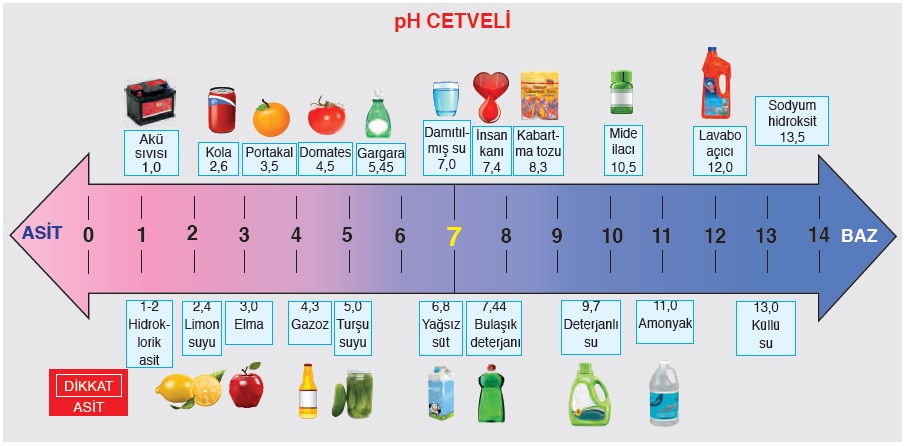
PH ölçeği (cetveli):
- Maddelerin asitlik-bazlık derecesini gösteren cetveldir. PH metre 0-14 arasında değer alır.
- PH metre 0-7 arasında asidik, 7 değerinde nötr(tuz), 7-14 arasında bazik özelliktedir.
- PH metre 0’a yaklaştıkça asidik, 14’e yaklaştıkça bazik özellik artar.
Asit yağmurları:
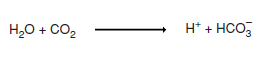
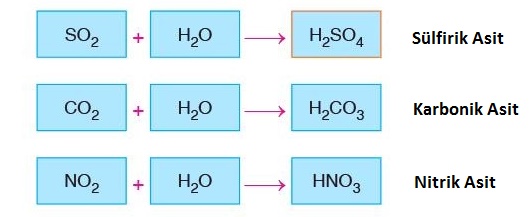
- Endüstriyel faaliyetlerin ve enerji tüketiminin fazla olduğu yerlerde yakılan kömür, petrol gibi fosil yakıtlardan karbondioksit (CO2 ), kükürtdioksit (SO2 ) ve azotdioksit (NO2 ) gazları açığa çıkarak hava kirliliğine neden olur.
- Kirliliğe sebep olan bu gazlar havadaki su buharı ile tepkimeye girerek asit yağmurlarına neden olur.
- Asit yağmurları düştükleri yerlerde ağır tahribatlara neden olurlar.
Asit Yağmurlarının Etkisini En Aza İndirmek İçin Alınabilecek önlemler:
- Enerji üretiminde kullanılan termik santrallerin yerine, yenilenebilir enerji kaynaklarının kullanımı yaygınlaştırılmalıdır. (Güneş Enerjisi, Jeotermal Enerji, Rüzgar Enerjisi vs.)
- Orman yangınları engellenmeli, yeşil alanlar yaygınlaştırılmadır.
- Şehir içi ulaşımlarda özel araçların yerine toplu taşıma araçları kullanılmalıdır.
- Havayı olduğundan fazla kirleten kaçak kömür kullanımının önüne geçilmelidir.
- Endüstriyel tesislerinin bacalarına filtre takılmalıdır.
- Araçların bakımı zamanında yapılmalıdır.
Günlük yaşamda asit ve bazlar:
| ASİT |
BAZ |
|
Tuzruhu – Hidroklorik asit – (HCl) |
Sud Kostik – Sodyum Hidroksit – (NaOH) |
| Kezzap – Nitrik asit – (HNO3) |
Potas Kostik – Potasyum Hidroksit – (KOH) |
| Zaç yağı – Sülfirik asit – (H2SO4) |
Sönmüş Kireç – Kalsiyum Hidroksit – (Ca(OH)2) |
|
Fosfor asidi – Fosforik asit – (H3PO4) |
Amonyak – (NH3) |
|
Sirke asidi – Asetik asit – (CH3COOH) |
Çamaşır sodası |
|
Karınca asidi – Formik asit – (HCOOH) |
Çamaşır suyu |
| Gazoz – Karbonik Asit – (H2CO3) |
Sabun |
| Kolalı içecekler – Fosforik asit |
Şampuan |
|
Elma – Malik asit |
Diş macunu |
|
Limon – Sitrik asit |
Kan |
|
Yoğurt – Laktik asit |
Mide ilacı |
|
Çilek – Folik asit |
Kabartma tozu |
| Üzüm – Tartarik asit |
Kül |
|
Turşu – Benzoik ait |
Kireç suyu |
|
Reçel – Sorbik asit |
Çikolata |
|
Isırgan – Formik asit |
Mayonez |
| Tereyağ – Bütirik asit |
Kan |
| Zeytinyağı – Oleik asit |
Bulaşık deterjanı |
| Aspirin |
Gübre |
“ASİTLER VE BAZLAR” KONU ANLATIMINI PDF OLARAK İNDİR.
İlgili İçerikler
-
 Kimya Endüstrisi
Yorum yapılmamış | Şub 21, 2022
Kimya Endüstrisi
Yorum yapılmamış | Şub 21, 2022 -
 Madde Döngüleri ve Çevre Sorunları
Yorum yapılmamış | Nis 17, 2021
Madde Döngüleri ve Çevre Sorunları
Yorum yapılmamış | Nis 17, 2021 -
 Adaptasyon
Yorum yapılmamış | Kas 2, 2022
Adaptasyon
Yorum yapılmamış | Kas 2, 2022 -
 Sunu: Mevsimlerin Oluşumu
Yorum yapılmamış | Eyl 3, 2020
Sunu: Mevsimlerin Oluşumu
Yorum yapılmamış | Eyl 3, 2020
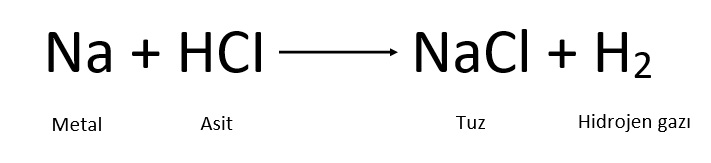
Hocam bilgilerinizi youtube kanalımızda kullanabilirmiyiz
tabiki kullanabilirsiniz.