Kimyasal Tepkimeler
Maddenin iç yapısında meydana gelen değişimler sonucu maddenin kimliğinin değişmesine kimyasal değişim denir. Farklı maddelerin etkileşimi sonucunda kendi özelliklerini kaybedip yeni maddeler oluşumuna kimyasal tepkime denir.
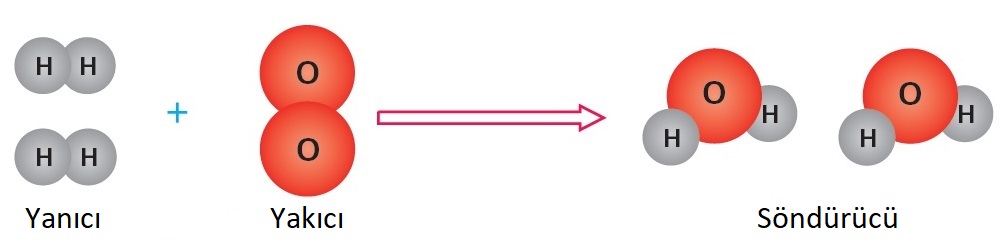
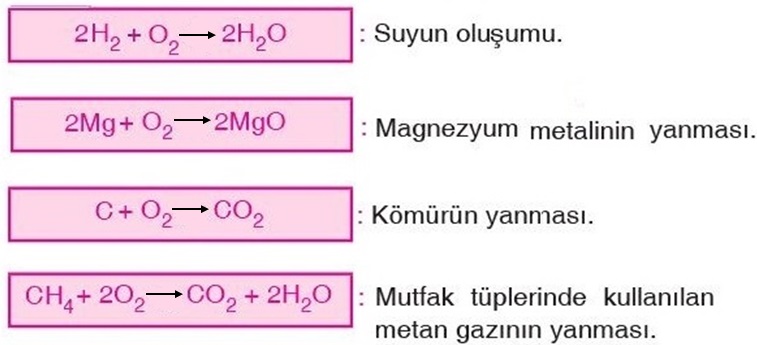
Yanıcı bir madde olan hidrojen gazı, yakıcı bir madde olan oksijen ile tepkimeye giriyorlar. Tepkime sonucunda kendi özelliklerini kaybediyorlar ve söndürücü özelliğe sahip olan suya dönüşüyorlar.
Kimyasal tepkimelerle ilgili bilinmesi gerekenler:
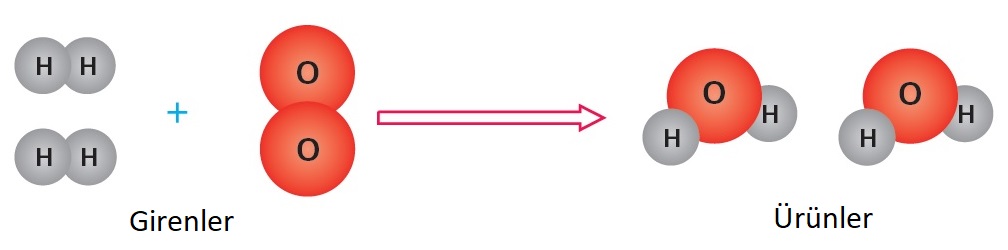
- Kimyasal tepkimelerde tepkimeye giren maddelere girenler, tepkime sonucu oluşan maddelere ürünler denir. Tepkimeye giren maddeler ok işaretinin solunda, tepkime sonucunda oluşan ürünler ok işaretinin sağında yer alır.
- Kimyasal tepkimelerde bir madde vardan yok olmaz, yoktan da var olmaz. Girenlerde hangi çeşit atom varsa ürünlerde de onlar vardır. Aşağıdaki tepkimeyi incelediğimiz zaman girenlerde Karbon, Hidrojen ve Oksijen atomlarını görmekteyiz. Ürünlere baktığımızda da yine aynı atomları görmekteyiz.
- Girenlerdeki atom sayısı ne kadarsa ürünlerde de eşit miktarda olması gerekir. Örneğin yukardaki tepkimeyi inceleyelim. Girenlerdeki Karbon(C) atom sayısı 3, Hidrojen(H) atom sayısı 8, Oksijen(O) atom sayısı 10; Ürünlerdeki Karbon(C) atom sayısı 3, Hidrojen(H) atom sayısı 8, Oksijen(O) atom sayısı 10 adettir. Buradan da anlaşıldığı üzere girenlerdeki atom sayısı ne kadar ise ürünlerdeki atom sayısı da o kadardır.
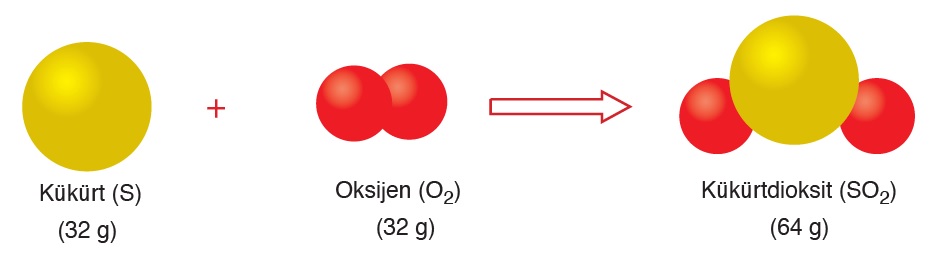
- Kimyasal tepkimelerde girenlerin kütlesi daima ürünlerin kütlesine eşittir.(kütlenin korunumu yasası) Örneğin 32 g S ile 32 g O2 tepkimeye girerek 64 g SO2 oluşur.
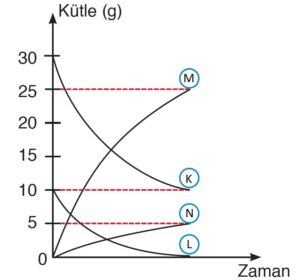
- Kimyasal tepkimelerde, kütle-zaman grafiği hakkında yorum yapılırken miktarı zamanla azalan maddelerin girenler tarafında, miktarı zamanla artan maddelerin ürünler tarafında olduğu bilinmelidir. Aşağıdaki grafiği incelediğimizde zamanla miktarı azalanların K ve L maddeleri olduğu görülmekte, miktarı zamanla artan maddelerin de M ve N maddeleri olduğu görülmektedir. Bu yüzden K ve L maddelerini girenlere, M ve N maddelerini ürünlere yazmamız gerekmektedir.
- Kimyasal tepkimeler elektron alışverişi ya da elektron ortaklaşa kullanımı sonucunda gerçekleşir. Bu nedenle tepkimeye giren maddelerin elektron sayısı değişebilirken; proton sayısı ve nötron sayısı değişmez.
- Kimyasal tepkimeler sonucunda renk değişimi, ısı açığa çıkması, koku değişimi gibi özellikleri ortaya çıkabilir.
- Kimyasal tepkimelerde:
-
- Atom türü ve sayısı,
- Toplam kütle,
- Toplam proton, nötron, elektron ve yük gibi özellikler kesinlikle değişmez.
-
- Kimyasal tepkimelerde:
-
- Fiziksel özellikler,
- Molekül sayıları,
- Oluşan madde sayısı,
- Atomun elektron sayısı,
- Toplam hacim gibi özellikler değişebilir.
-
Yanma tepkimeleri:
- Bir maddenin oksijen gazı(O₂) ile tepkimeye girerek yeni maddeler oluşturmasıdır.
- Girenlerde oksijen(O₂) tek başına var ise tepkime, yanma tepkimesidir.
- Yanma olayının olabilmesi için;
-
- Yakıcı madde(O₂),
- Yanıcı madde,
- Tutuşma sıcaklığının olması gerekir.
-
- Yanma sırasında alev oluşan ve hızlı olan tepkimler hızlı yanmadır. Odunun yanması, kağıdın yanması, metanın yanması gibi.
- Yanma sırasında alev oluşmaz ve uzun sürede gerçekleşen tepkimeler yavaş yanmadır. Demirin paslanması, solunum, yaprağın çürümesi gibi.