Maddelerin Isı ile Etkileşimi
Isı ve Sıcaklık:
- Isı maddeler arasında alınıp verilen enerjinin adıdır. Isı, maddenin taneciklerinin toplam hareket enerjisidir.
- Sıcaklık, maddenin taneciklerinin ortalama hareket enerjilerinin bir göstergesidir.
- Isı bir enerji çeşididir. Sıcaklık ise bir enerji değil, ölçümdür.
- Isı maddeler arasında alınıp verilebilir, sıcaklık alınıp verilemez.
- Isının birimi joule veya kaloridir. Sıcaklığın birimi ise derecedir.
- Isı madde miktarına bağlıdır, sıcaklık madde miktarına bağlı değildir.
- Isı kalorimetre kabı ile hesaplanır, sıcaklık termometre ile ölçülür.
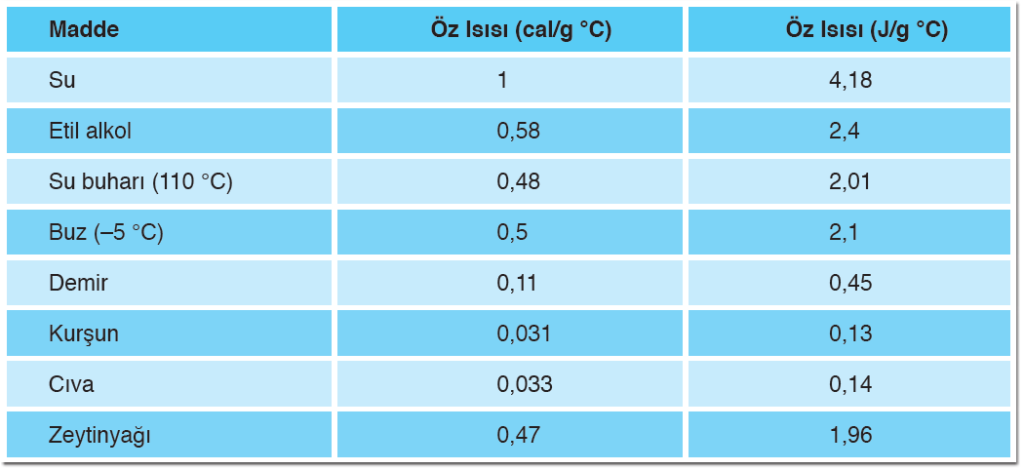
Özısı:
- 1 gram maddenin sıcaklığını 1 °C artırmak için gerekli olan ısı miktarına özısı denir.
- “c” ile gösterilir.
- Kalori ve joule ısı birimleri olduğu için, öz ısı birimleri cal / g°C veya j / g°C’ dir.
- Her maddenin kendine ait bir özısı vardır. Bu yüzden özısı maddeler için ayırt edici bir özelliktir.
- Bir maddenin katı, sıvı ve gaz halleri için özısı değerleri birbirinden farklıdır.
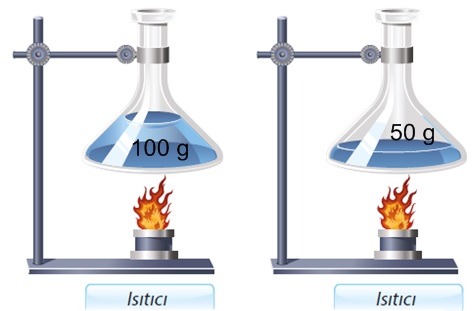
- Özısı madde miktarına bağlı değildir, maddenin cinsine bağlıdır. Bir bardak su ile bir tencere suyun özısıları aynıdır.
- Özısısı büyük olan maddeler geç ısınıp geç soğurken; özısı küçük olan maddeler erken ısınıp erken soğumaktadır. Bir maddenin öz ısısı ne kadar büyükse o maddenin sıcaklığını artırmak o kadar zordur. Örneğin zeytinyağının öz ısısı, sudan küçük olduğu için zeytinyağı sudan daha çabuk ısınır.
Günlük hayatta özısı:
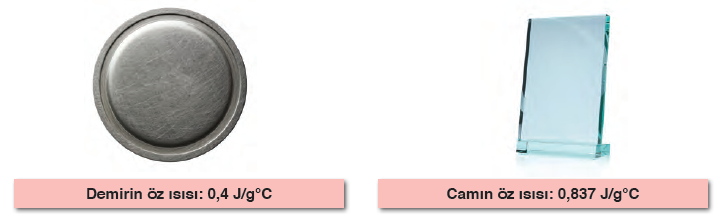
- Güneş altında kalan bir arabanın metal kısımlarının sıcaklığı, cam kısmının sıcaklığından büyüktür. Çünkü metal yüzeyin özısı değeri daha küçüktür.
- Güneşli bir günde demir bir bank tahta banktan daha sıcak olur. Soğuk bir kış gününde demir bank tahta banktan daha soğuk olur.
- Yağın sıcaklığını artırmak suyun sıcaklığını artırmaktan daha kolaydır.
- Termometrelerde özısı değeri küçük olan civa kullanılması. Böylece daha hassas ölçümler yapılır.
- Tencere içerisine aynı anda konulan metal kaşığın tahta kaşığa göre daha sıcak olması.
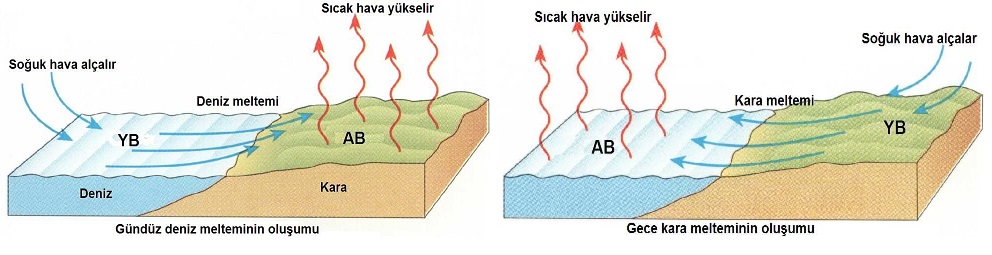
- Kara ve denizlerde özsısı farkında dolayı gece ve gündüz meltemi oluşması. Karaların özısı değeri küçük oluğu için erken ısınır erken soğur. Denizlerin özısı değeri büyük olduğu için geç ısınır geç soğur.
Isı alışverişi ve sıcaklık değişimi:
- Tüm maddelerin tanecikleri hareket halindedir. Madde taneciklerinin bu hareketi maddenin sıcaklığı ile doğru orantılıdır. Sıcaklık arttıkça maddenin taneciklerinin hareketliliği de artar.
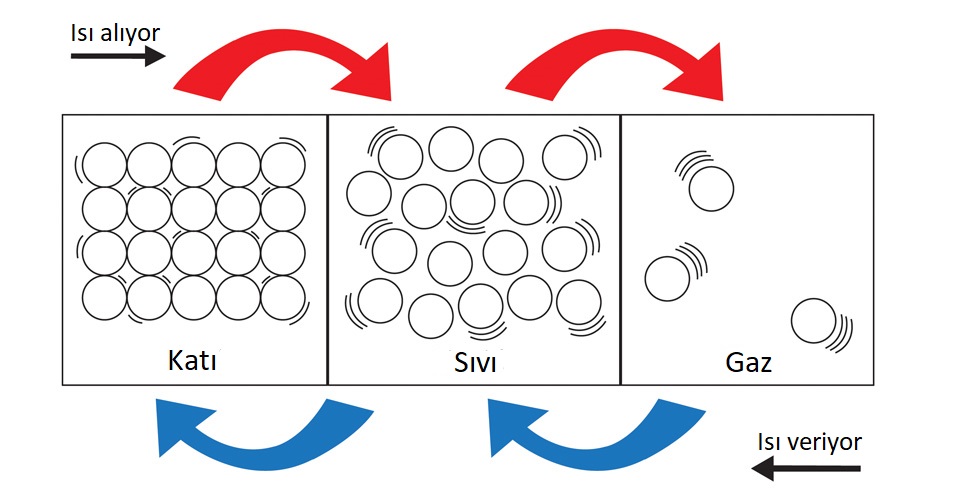
- Madde ısı aldığı zaman;
- Taneciklerinin enerjisi artar,
- Tanecikler arasındaki mesafe artar
- Tanecikler arasındaki çekim kuvveti azalır
- Tanecikler düzensizleşir.
- Bir maddeye verilen ısı miktarı sabit tutulup;
- Maddenin kütlesi artırılırsa sıcaklık artışı azalır.
- Maddenin kütlesi azaltılırsa sıcaklık artışı artar.
- Maddenin miktarı sabit tutulup;
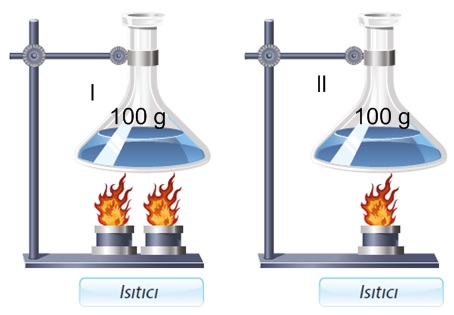
- Verilen ısı miktarı artırılırsa sıcaklık artışı artar.
- Verilen ısı miktarı azaltılırsa sıcaklık artışı azalır.
- Maddeler arasında ısı alışverişi olması için sıcaklıkların kesinlikle farklı olması gerekir.
- Sıcaklığı aynı olan maddeler arasında ısı alışverişi gerçekleşmez.
- Isı alışverişinde ısı akış yönü daima sıcaktan soğuğa doğrudur.
- Isı akışı maddelerin son sıcaklıkları eşit olana kadar devam eder. Meydana gelen son sıcaklığa denge sıcaklığı denir. Denge sıcaklığı maddelerin ilk sıcaklıkları arasında bir değer alır.
- Isı alışverişinde daima alınan ısı verilen ısıya eşittir.
- Sıcaklıkları aynı, miktarları farklı olan aynı cins maddelerden miktarı fazla olanın sahip olduğu ısı enerjisi de fazladır.
Hâl Değişimi ve Isı Arasındaki İlişki
Madenin hal değişimi:
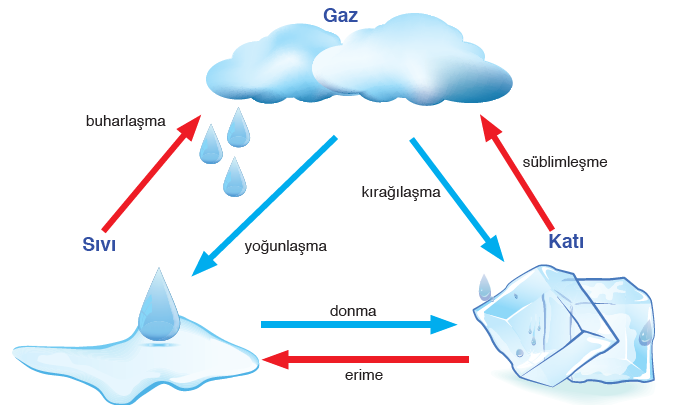
Erime: Katı haldeki maddenin çevresinden ısı alarak sıvı hale geçmesine denir.
- Dondurmanın yazın erimesi
- Mumun erimesi
- Margarinin tavada erimesi
- Meyve suyu gibi içeceklerin içine attığımız buz parçalarının belirli bir süre sonra erimesi.
Donma: Sıvı haldeki maddenin çevresine ısı vererek katı hale geçmesine denir.
- Kışın akarsu yüzeylerinin donması
- Buzdolabına konulan suyun donması
Unutma! Maddeler donarken çevrelerine ısı verir. Bu yüzden kış aylarında kar yağarken hava biraz ısınır.
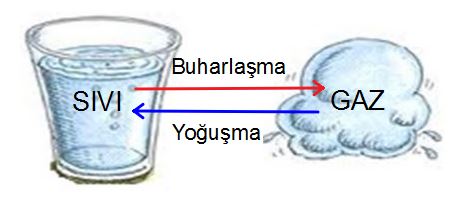
Buharlaşma: Sıvı haldeki maddenin çevresinden ısı alarak gaz haline dönüşmesine denir.
Buharlaşma sıvı yüzeyinde olur.
Buharlaşma her sıcaklıkta olur, bu yüzden soğuk havada bile çamaşırlarımız kurumaktadır.
Sıcaklık arttıkça buharlaşma hızı da artar. Örneğin güneş alan bir yere asılan çamaşırlar daha çabuk kurumaktadır.
- Suyun, su buharı haline gelmesi
- Elimize dökülen kolonyanın buharlaşması
- Yaz aylarında göllerdeki suların azalması
- Islak çamaşırların kuruması
Kaynama: Çevresinden ısı alan sıvıların kabarcıklar oluşturarak hızlı bir şekilde buharlaşması olayıdır.
Kaynama ve buharlaşma arasındaki farklar:
- Buharlaşma sıvının yüzeyinde olur, kaynama sıvının her tarafında olur.
- Buharlaşma her sıcaklıkta olur, kaynama belirli bir sıcaklıkta olur.
- Madde buharlaşırken sıcaklık değişebilir, kaynama sırasında sıcaklık sabit kalır.
Yoğuşma: Gaz haldeki maddenin çevresine ısı vererek sıvı hale geçmesine denir.
- Su buharının tekrar su haline dönüşmesi
- Soğuk havalarda evimizdeki camların buğulanması
- Buzdolabından çıkarılan şişenin yüzeyinin buğulanması
- Yağmurun yağması.
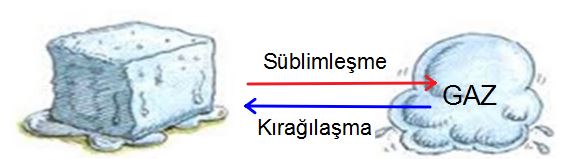
Süblimleşme: Katı haldeki maddenin çevresinden ısı alarak sıvı hale geçmeden direk gaz hale geçmesine denir.
- Dolapta giysilerin arasına ya da tuvaletlerde koku giderme amaçlı kullanılan naftalinin katı hâlden direkt gaz hâl geçmesi.
- Kuru buzun doğrudan gaz haline geçmesi
Kırağılaşma: Gaz haldeki bir maddenin çevresine ısı vererek sıvı hale geçmeden direk katı hale geçmesine denir.
- Kışın havadaki su buharının aniden katılaşıp kırağıya dönüşmesi.
Hal değiştirme ile ilgili özellikler:
- Saf maddelerin kendilerine ait belirli erime, donma, kaynama noktaları vardır. Bu yüzden erime noktası, donma noktası, kaynama noktası bütün saf maddeler için ayırt edici özelliktir.
- Erime noktası donma noktasına, kaynama noktası yoğuşma noktasına eşittir.
- Madde miktarının değişmesi hal değişim noktalarını etkilemez, sadece hal değişim süresini etkiler. Örneğin bir bardak su ve bir tencere suyun kaynama noktaları aynıdır.
- Isıtıcının gücü hal değişim noktalarını etkilemez sadece hal değişim süresini etkiler. Örneğin kısık ateş yerine tam açık ocak kullanılırsa tenceredeki su daha çabuk kaynar.
- Dış basınç ile buhar basıncının eşit olduğu zaman kaynama olayı gerçekleşir. Bundan dolayı yükseklere doğru çıkıldıkça kaynama noktası düşer.
- Hava akımı buharlaşmayı kolaylaştırır. Rüzgarda çamaşırların kuruması bu yüzdendir.(basınç azalırsa buharlaşma hızlanır.)
- Saf bir maddeye eklenen farklı cins maddeler saf maddenin erime ve kaynama sıcaklığını değiştirir. Örneğin kışın yollara tuz atılarak soğuk havada bile karların erimesini sağlamak bu yolla yapılır.
- Hal değiştiren maddelerin, hal değişimi süresince sıcaklıkları sabit kalır.
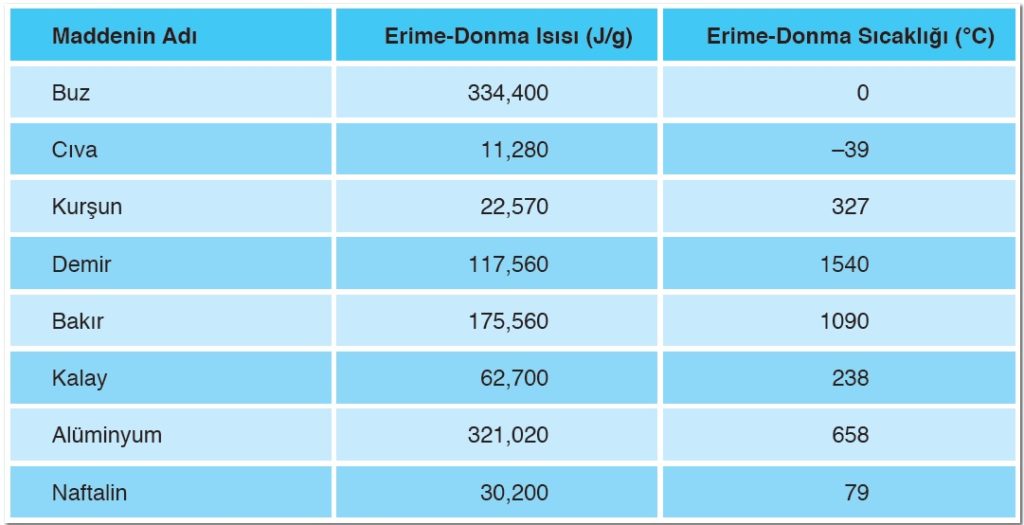
Erime Sıcaklığı: Bir maddenin, yeterli ısı alarak katı hâlden sıvı hâle geçmesi sırasında gerçekleşen olaya erime denir. Katı bir maddenin ısı alarak sıvı hâle geçtiği sıcaklığa ise erime sıcaklığı (erime noktası) denir.
Erime Isısı: Erime sıcaklığında bulunan 1 g katı maddenin, aynı sıcaklıkta 1 g sıvı madde hâline dönüşmesi için katı maddeye verilen ısı miktarına erime ısısı denir. Erime ısısı Le ile gösterilir ve birimi cal/g ya da j/g’dır. Erime sıcaklığı ve erime ısısı saf maddelerin ayırt edici bir özelliğidir.
Donma Sıcaklığı: Sıvı bir maddenin ısı kaybederek katı hâle geçmesi sırasında gerçekleşen olaya donma (katılaşma) denir. Sıvı maddelerin çevreye ısı vererek katı hâle geçtiği sıcaklık değerine donma sıcaklığı (donma noktası) denir.
Donma Isısı: Donma sıcaklığında bulunan 1 gram sıvının yine aynı sıcaklıkta tamamen katı hâle geçmesi için çevreye verdiği ısı miktarına donma ısısı denir. Donma ısısı Ld ile gösterilir. Birimi cal/g ya da j/g’dır.
Donma sıcaklığı ve donma ısısı, maddelerin ayırt edici bir özelliğidir. Aynı saf madde için erime noktası donma noktasına, erime ısısı da donma ısısına eşittir. Farklı maddelerin erime-donma sıcaklıkları ve erime-donma ısıları ise farklıdır.
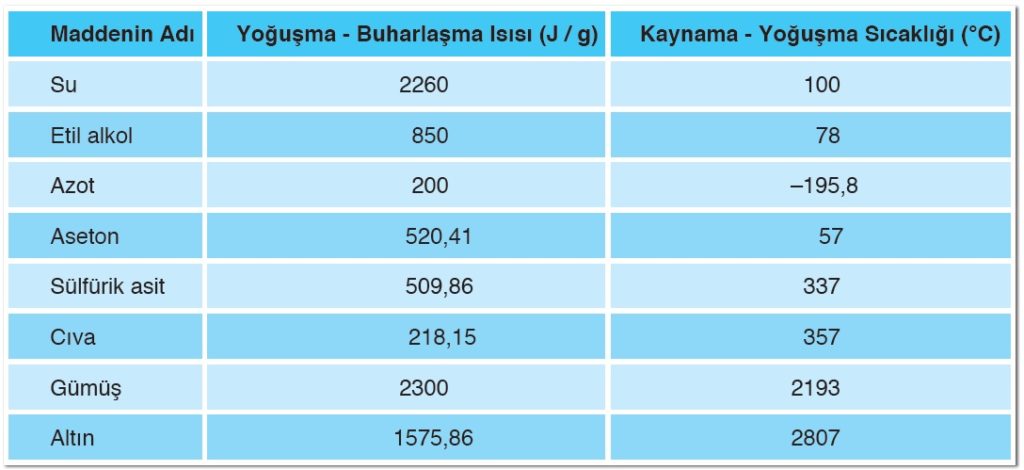
Buharlaşma Isısı: Kaynama sıcaklığındaki 1 g sıvının, aynı sıcaklıkta 1 g buhar hâline geçebilmesi için sıvıya verilmesi gereken ısı miktarı buharlaşma ısısı olarak tanımlanır. Buharlaşma ısısı Lb ile gösterilir. Birimi cal/g ya da j/g’dır.
Yoğunlaşma Isısı: Gaz hâlindeki bir maddenin, çevreye ısı vererek sıvı hâle geçmesi sırasında gerçekleşen olaya yoğunlaşma (yoğuşma) denir. Yoğunlaşma sıcaklığında bulunan 1 g buharın yine aynı sıcaklıkta 1 g sıvı hâle geçmesi için dışarıya vermesi gereken ısıya ise yoğunlaşma ısısı adı verilir. Yoğunlaşma ısısı Ly ile gösterilir. Birimi cal/g ya da J/g’dır.
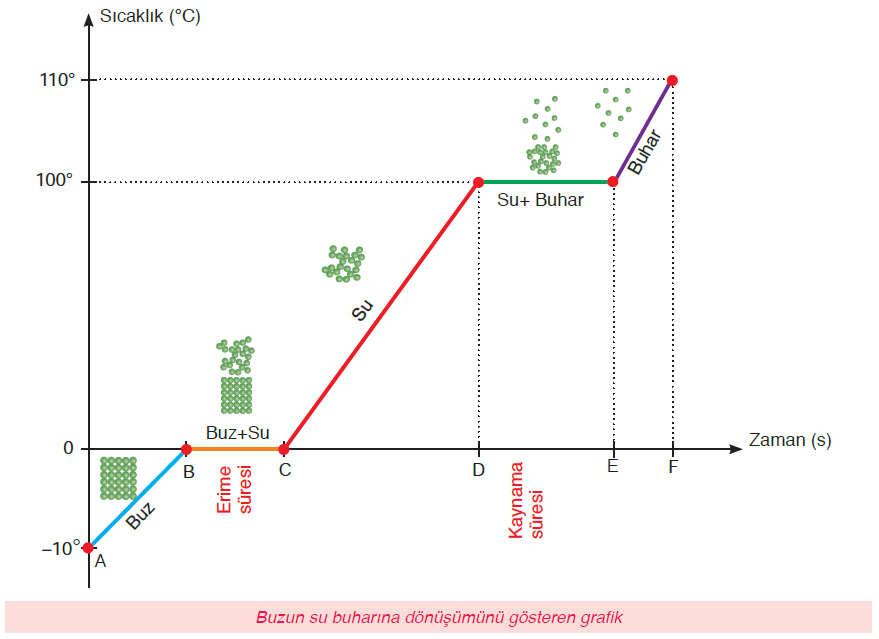
Hal değişim grafikleri:
Isınma eğrisi:
A-B arasında;
- Madde katı haldedir.
- Maddeye ısı verildikçe maddenin sıcaklığı artar.
- Maddenin sıcaklığı arttığı için kinetik enerjisi artar.
B-C arasında;
- Madde B noktasından itibaren erimeye başlar.
- B-C maddenin erime noktasıdır.
- Madde katı halden sıvı hale dönüşmektedir.
- Madde hal değiştirdiği için sıcaklığı değişmez.
- Sıcaklığı değişmediği için kinetik enerjisi de değişmez.
- Madde katı+sıvı halde bulunur.
- C noktasından sonra tamamen sıvı hale geçer.
C-D arasında;
- Madde sıvı haldedir.
- Madde ısı aldıkça sıcaklığı artar.
- Sıcaklık arttığı için kinetik enerjisi de artar.
D-E arasında;
- D-E kaynama noktasıdır.
- D noktasından itibaren madde kaynamaya başlar.
- Madde sıvı halden gaz hale dönüşmektedir.
- Madde sıvı+gaz halde bulunmaktadır.
- Madde hal değiştirdiği için sıcaklık değişmez.
- Sıcaklık değişmediği için kinetik enerjide değişmez.
E’den sonra;
- Madde gaz haldedir.
- Isı verildikçe sıcaklık artmaya devam eder.
- Sıcaklık arttığı için kinetik enerji de artmaya devam eder.
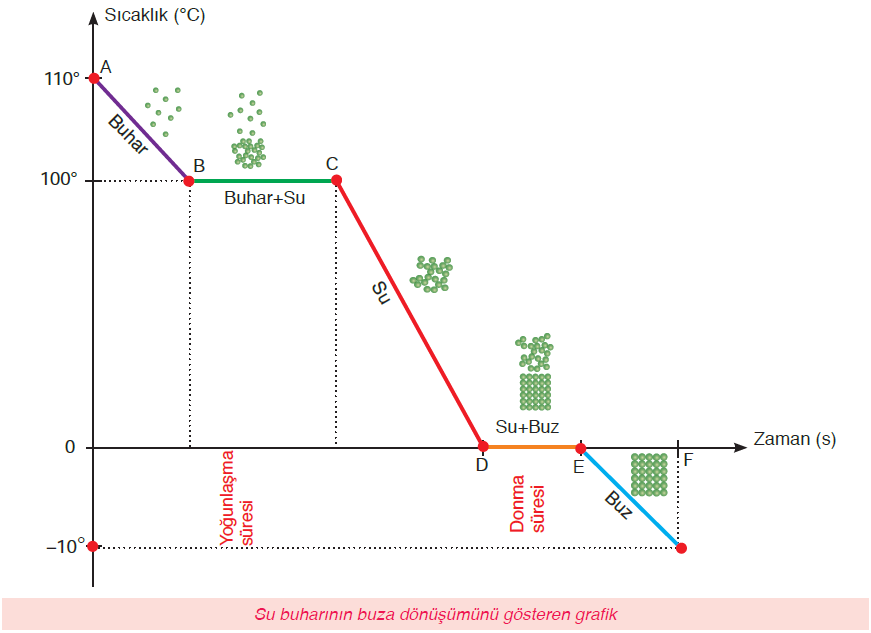
Soğuma Eğrisi:
A-B arasında;
- Madde gaz haldedir.
- Madde soğumaya devam ettiği için sıcaklığı azalır.
- Maddenin sıcaklığı azaldığı için kinetik enerjisi azalır.
- B noktasında buhar yoğunlaşmaya başlar.
B-C arasında;
- Madde B noktasından itibaren yoğuşmaya başlar.
- B-C maddenin yoğuşma noktasıdır.
- Madde gaz halden sıvı hale dönüşmektedir.
- Madde hal değiştirdiği için sıcaklığı değişmez.
- Sıcaklığı değişmediği için kinetik enerjisi de değişmez.
- Madde gaz+sıvı halde bulunur.
- C noktasından sonra tamamen sıvı hale geçer.
C-D arasında;
- Madde sıvı haldedir.
- Madde ısı verdikçe sıcaklığı azalır.
- Sıcaklık azaldığı için kinetik enerjisi de azalır.
D-E arasında;
- D-E donma noktasıdır.
- D noktasından itibaren madde donmaya başlar.
- Madde sıvı halden katı hale dönüşmektedir.
- Madde sıvı+katı halde bulunmaktadır.
- Madde hal değiştirdiği için sıcaklık değişmez.
- Sıcaklık değişmediği için kinetik enerjide değişmez.
E’den sonra;
- Madde katı haldedir.
- Soğudukça sıcaklık azalmaya devam eder.
- Sıcaklık azaldığı için kinetik enerji de azalmaya devam eder.





selamünaleyküm maden yada metal olarak ısındıktan sonra geç soğumaya başlayan bir element mevcut mu? birkere ısındığında soğuması geç olan bir metal yada element
örn: 50derece ısıtıldıktan sonra uzun süre 50 derece kalıp sonra soğumaya geçecek şekilde olacak