Karışımlar
- İki veya daha fazla maddenin birbirleri içerisinde kendi özelliklerini kaybetmeden rastgele miktarlarda dağılmasıyla karışım oluşur.
- Karışımlar saf madde değildir.
- Karışımlar kendini oluşturan maddelerin özelliklerini gösterir. Yani karışımların oluşumu sonucunda yeni madde oluşmaz. Örneğin salatanın içerisinde bulunan domatesler veya salatalıklar kendi özelliklerini göstermeye devam eder.
- Karışımı oluşturan maddeler istenilen her oranda birleştirilebilir. Örneğin bir salatanın içerisine istediğimiz miktarda domates veya istediğimiz miktarda salatalık ekleyebiliriz.
- Karışımlar en az iki farklı maddeden oluşur. Örnek olarak salatanın yapılabilmesi için iki veya daha fazla sebze veya meyve kullanılmalıdır.
- Karışımlar sembol veya formülle gösterilmez. Örneğin salatanın bir sembolü ve formülü yoktur
- Karışımlar fiziksel yollarla (buharlaştırma, yoğunluk farkı, damıtma vb.) ayrıştırılır.
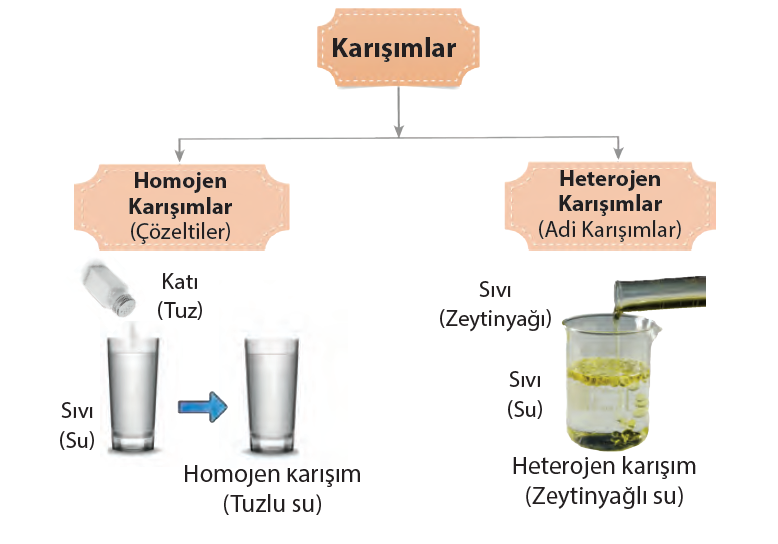
- Karışımlar görünümlerine göre homojen karışım(çözeltiler) ve heterojen karışım(adi karışım) olarak ikiye ayrılır.
Heterojen karışım:
- Karışımı oluşturan maddelerin dağılımı karışımın her yerinde aynı değilse bu karışımlara heterojen karışım denir.
- Heterojen karışımlara bakıldığında tek bir maddeymiş gibi görülmez, karışımı oluşturan maddeler dışardan bakıldığında fark edilebilir.
Homojen karışım:
- Karışımı oluşturan maddelerin dağılımı karışımın her yerinde aynı ise bu karışımlara homojen karışım
- Homojen karışımlar, çözücü bir madde içerisinde başka bir maddenin çözünmesi sonucu oluşur.
- Tuzlu su, şekerli su, hava, kolonya ve gazoz homojen karışımlara örnektir.
Çözelti:
- Homojen karışımlarda bir madde, başka bir madde içinde çözündüğü için bu karışımlara çözelti adı verilir. Dolayısıyla çözeltiler homojen karışımlardır.
- Çözeltilerde bir çözücü madde, bir de çözünen madde bulunur. Çözelti içerisinde miktarı çok olan maddeye çözücü, miktarı az olan maddeye çözünen denir.
Çözünme hızına etki eden faktörler:
Sıcaklık: Çözelti oluşurken sıcaklığın yükselmesi çözücü ve çözünen maddenin taneciklerini hızlandırır. Bu nedenle sıcaklık artışı, çözücü katı veya sıvıysa çözünme hızını arttırır. Örneğin sıcaklığı yüksek olan çaya atılan şeker, sıcaklığı düşük olan çaya atılan şekerden daha hızlı çözünür.
Tanecik Boyutu: Çözünen maddenin ezilerek küçük parçalara ayrılması ya da toz haline getirilmesi temas yüzeyini arttıracağı için çözünme hızını arttırır.
Karıştırma: Çözelti oluşumu sırasında karıştırma ya da sallama etkisi, katı-sıvı ve sıvı-sıvı çözeltilerin çözelti oluşum hızını arttırır. Örneğin çaya atılan şeker karıştırılırsa daha hızlı çözünür.
Element, Bileşik ve Karışımların karşılaştırılması
|
Elementler |
Bileşikler | Karışımlar |
|
Saf madde |
Saf madde | Saf madde değil |
|
Sembolle gösterilir |
Formülle gösterilir |
Bir sembolü veya formülü yoktur |
| Daha basit maddelere ayrışamazlar. | Kimyasal yöntemlerle kendini oluşturan maddelere ayrışabilir. |
Fiziksel yöntemlerle kendi oluşturan maddelere ayrışabilir. |
| Bileşeni yoktur. | Kendini oluşturan maddelerin özelliklerini taşımazlar. |
Kendini oluşturan maddelerin özelliklerini taşır. |





Sayfayı indiremiyorum malesef…